基于名老中医经验方的中药新药研发策略分析
来源:《中国实验方剂杂志》,2019,25,(14)
基于名老中医经验方的中药新药研发策略分析
王停1 通讯作者,林红梅1,周刚2,张林1,赵保胜1
(1. 北京中医药大学 北京中医药研究院,国家中医药管理局名医名方重点研究室,北京100029;
2. 国家药品监督管理局 药品审评中心,北京100022)
名老中医是当代中医临床最高水平的代表, 是解决临床疑难问题的锁钥, 是中医学术传承的主体。名老中医经验方是当代名老中医在临床实践过程中形成的确有疗效的方剂, 体现了中医对疾病发生发展规律及核心病机的认识, 是组方用药规律的宝贵经验, 代表了中医临床最高诊疗水平的治疗方案, 也是新药研发和科技创新的主要源头。传承名老中医的学术思想和临床经验, 挖掘、 整理名老中医经验方, 开发出中药新药, 具有重大的现实意义。然而现有的研发理念和方法, 在一定程度上并未将名老中医经验方很好地开发成上市的中成药, 甚至制约了名老中医经验方新药研发工作。为了更好地推进名老中医经验方新药研发工作顺利开展, 充分发挥名老中医经验方在中药新药研发中的独特优势, 本文通过分析近年来中药新药的审评情况, 结合中药新药研发实际工作现状, 针对目前名老中医经验方新药研发中存在的问题, 强调以临床价值为导向、 重视人用历史、 全过程质量控制的中药新药研发理念, 并从研发的药学、 药效毒理以及临床环节进行了深入的分析和探讨, 总结出一套行之有效的研发策略, 旨在为广大中药新药研发机构和人员提供借鉴和参考。
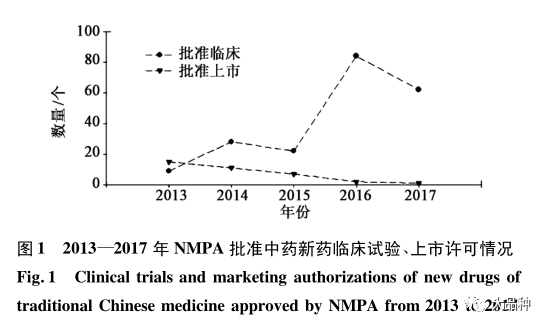
1近年来中药新药批准情况
通过对 2013—2017 年国家药品监督管理局(NMPA)发布的年度药品注册审评报告中的获准上市及获准临床的中药新药数据进行分析及总结,见图1, 发现批准临床的中药新药虽有一定的波动,但整体数量(包含基于名老中医经验方开发的新药) 趋于增长,而批准上市的中药新药逐年减少。分析其原因, 一方面 NMPA 提高了中药新药研发的技术要求;另一方面, 研发人员对国家中药新药的审评理念及相关技术要求了解不够, 导致在中药新药研发策略上存在一定问题, 这才是中药新药批准上市数量低的主要原因。
2药品审评中心理念的转变
近年来 NMPA 基于中药新药研发规律调整了审评理念, 不断强化“以临床价值为导向、 重视人用历史” 的中药新药审评理念。其中“以临床价值为导向” 是中药和化药共同遵循的审评理念, 考虑到中药新药研发多源于临床经验方, 尤其是来源于名老中医经验方的中药新药, 还应充分重视人用历史。正是这个人用历史, 恰恰包含着丰富的有效性和安全性信息, 相当于药物研发临床的 0 期。基于名老中医经验方的中药新药研发是从临床到实验室再到临床的研究过程, 而化药新药研发则是从实验室到临床的研究过程。然而, 如何建立具有中医药特色的名老中医经验方中药新药研发模式? 就必须在“以临床价值为导向、 重视人用历史、 全过程质量控制” 研发理念指导下, 并将其深入到研发的各个环节, 按照中药新药研发规律和特点, 摸索出一套具有中医药特色的名老中医经验方中药新药研发技术体系, 指导广大研发人员, 以确保研发出更多满足临床需求的安全、 有效、 质量可控的中药新药。
3名老中医经验方中药新药研发策略
3. 1药学
3. 1. 1工艺研究 从目前名老中医经验方中药新药申报资料来看, 工艺研究中主要存在两个问题, 第一, 唯成分论, 这种研究思路的主要问题在于未考虑到中药复方前期临床应用工艺是提取纯化工艺设计的重要依据;其二, 盲目纯化, 一味减少服用量。最终将一个 “有效安全的处方” 制成“无效或不安全的制剂” 。如痔血胶囊处方由苦参、 白鲜皮 2 味药材组成, 来源于临床经验方, 传统用法为全方水煎煮。药物研发时工艺研究仅从药物成分考虑, 全方采用85%乙醇回流提取, 导致其上市后陆续出现与该药有关肝损伤的不良反应报告。有学者研究痔血胶囊不同工艺(水提工艺和醇提工艺)对大鼠肝损害的影响, 结果表明, 全方醇提工艺组存在明确的肝脏毒性, 而全方水提工艺组未见明显肝毒性, 并且其肝毒性大小与提取溶剂中乙醇含量呈正相关。由此表明, 临床应用的有效性和安全性才是中药新药工艺研究的目标。对于来源于名老中医经验方的中药复方制剂, 工艺研究需以临床为导向, 同时重视人用历史, 结合临床应用情况, 在文献研究以及有效性、 安全性研究试验数据的基础上, 选择有效、 安全的工艺路线。
3. 1. 2 中药全过程质量控制体系 中药全过程质量控制体系是贯穿于中药新药研发各环节, 通过以综合指标、 或在指标体系中遴选的关键指标, 建立源头控制、 过程控制及终点控制的体系, 以确保中药新药的安全性、 有效性和质量可控性。
源头控制, 针对药材基原、 产地、 采收加工、 贮藏及野生药材资源等影响中药质量的关键环节, 秉承用对药材、 用好药材、 用稳定及有可持续资源药材的原则。
过程控制, 为保证中药质量, 围绕每一个生产环节, 包括原辅料信息、 原料的前处理、 提取、 浓缩、 纯化、 干燥、 制剂成型以及主要设备, 把和质量相关的各环节用数据化方式表达。
终点控制, 中药复方制剂作为一个有机的整体,发挥多靶点协同治疗作用。复方中虽然成分复杂,但并不是方中各个中药成分的简单相加。因此, 其质量标准的建立应有别于控制单一活性成分的化学制剂。对于中药复方制剂质量标准的研究应按照以下4个原则, ①针对性, 应针对安全性、 有效性和稳定性设立质量控制指标物质。如马钱子中士的宁既是其活性成分, 又是毒性成分, 因此质量标准需对其重点监控并设定含量范围;对于有些挥发性成分,就产品而言既是有效成分又是不稳定性成分, 也需要建立质量控制指标物质。②阶段性, 分阶段不断提高完善。中药复方新药质量标准研究的过程是一个不断完善的过程, 不仅体现在新药上市前的研究过程中, 也体现在新药上市后不断提高和完善质量标准的过程中。③系统性, 原料、 辅料、 中间体、终产品的质量研究。④专属性, 质量控制方法要专属、 可行。
3. 2药理毒理
3. 2. 1药效学 名老中医经验方中药新药研发的处方均来源于名老中医的临床经验方或院内制剂,按照重视人用历史的研发理念, 若拟申报制剂的处方、 工艺与人用历史处方、 工艺相比较变化不大的情况下, 可根据临床应用情况减少药效学相关研究内容;若与人用历史处方、 工艺一致的情况下, 可免除药效学研究。另外, 考虑到中药的临床价值多体现在改善症状上, 这时次要药效学甚至比主要药效学模型更加重要。如对于原发性骨质疏松症中药新药研发, 一般而言, 主要药效学动物模型可采用去卵巢致大鼠骨质疏松模型或维甲酸致大鼠骨质疏松模型等, 次要药效学实验可采用镇痛、 抗炎、 活血化瘀实验等。但考虑到临床上骨质疏松症多伴有腰酸背痛等症状, 症状的改善是具有临床价值的, 故对定位于改善骨质疏松症临床症状的中药复方新药, 这些次要药效学试验就显得更为重要。
3. 2. 2毒理学 近年来, 随着中药复方制剂引起不良反应的报道逐渐增多, 使得中药复方制剂的安全性问题逐渐成为社会关注的热点。为了保护公众的健康, NMPA 提高了对中药复方制剂临床前安全性评价的技术要求。新的《药品注册管理办法(征求意见稿)》 已要求中药新药复方制剂毒理学试验必须在 GLP 认证资质单位进行。
对于中药复方制剂, 需以临床为导向建立一种具有中医药特色的毒理学研发模式, 并且鼓励体现中药临床的特点。①关于长期毒性实验剂量设计,长期毒性实验的目的是为临床服务的, 其剂量应根据药效学起效剂量设计, 长期毒性实验的低剂量一般略高于药效学的起效剂量, 中、 高剂量按一定间距设计。剂量设计过低, 会导致毒性暴露不全;剂量设计过高, 若低剂量出现毒性, 找不到安全剂量和安全范围, 无法为临床提供参考。②关于长期毒性实验周期, 应根据中医临床定位及临床应用情况来确定。如用于治疗糖尿病的中药新药, 临床可能会长期反复使用, 一般需按最长给药周期设计长期毒性实验。
3. 3临床
3. 3. 1立题依据 处方应明确处方的来源, 详细说明其应用、 筛选及演变过程, 如有人用历史的资料,可提供相应的临床预试资料和其他相关的证明资料。鉴于名老中医经验方中药新药研发的处方均源于名老中医临床经验方, 有其人用历史, 经过了一定病例数的临床验证, 对研发具有很高的参考价值。但研发者从制剂角度考虑, 往往会删减处方, 从而导致所研发制剂无效或出现安全性问题。因此, 为保证药品的有效性和安全性, 尽量不要将处方删减太多。
3. 3. 2功能主治 应根据组方特点、 中医药组方理论以及人用历史, 确定中医的功能主治, 拟定的主治病证(适应症)应注意对中西医疾病、 病情、 分期、 分型、 中医证候等方面的合理限定, 明确其临床定位。
关于适应症的选择, 一方面, 市场导向不等同于研发导向, 如市场上关于促进骨折愈合的中成药稀缺, 但由于受年龄、 骨折部位、 骨折类型、 手术类型、 固定方法等因素的影响, 促进骨折愈合临床疗效难以评价,此类中药新药研发难度极大;另一方面, 中医临床优势病种也不等同于审评优势病种(容易通过审评的病种), 如治疗女性输卵管阻塞性不孕症以及男性不育症的中药新药, 这些适应症虽然属于中医临床优势病种, 但根据法规相关要求, 此类适应症的新药
研发需观察对子二代的影响, 不属于审评优势病种,研发难度也很大。
3. 3. 3方解 应根据中医药理论对主治病证病因病机、 治法进行论述, 并对处方的君臣佐使加以分析, 以说明组方的合理性。方解的撰写不是各药功能的堆砌,“药有个性之专长, 方有合群之妙用”, 应围绕治则以中药药性理论阐述药物在处方中的作用, 按照中药配伍规律阐述药物间的配伍意义。
3. 3. 4临床定位 是临床研究的核心, 应体现公认的临床价值。其确定需根据药物的特点、 立题依据、非临床研究结果以及拟定适应症的疾病发生发展演变规律来制定。只有经过科学的临床定位, 合理设计疗程及选择疗效指标, 才能体现出新药的临床价值。如研发用于治疗慢性心衰中药新药的临床定位可从以下几个方面来考虑, 减少死亡和/或再住院;延缓或逆转心肌重构, 改善心功能;改善临床症状/体征;增加运动耐量, 提高生活质量。
3. 3. 5临床试验设计 ①中药临床试验常用的试验设计包括以安慰剂为对照的优效性设计、 以阳性药为对照的优效性设计、 以安慰剂及阳性药为双重对照的三臂试验设计及以阳性药为对照的非劣效设计。前 3 种设计方法是可行的, 但如果采用阳性药为对照的非劣效设计试验, 则需要提供阳性药有效性的依据。鉴于一些已上市的中成药由于历史原因未进行过完整、 规范的临床试验, 很难提供阳性对照药的临床有效性依据, 故在试验设计时需慎重考虑是否采用非劣效设计。②剂量- 效应关系研究, 中药新药剂量- 效应的探索性临床试验通常在Ⅱ期临床试验中完成, 名老中医经验方中药复方制剂一般应进行剂量- 效应关系研究, 鉴于有人用历史的原因,除安慰剂组以外有 2 ~ 3 个剂量组即可。③加载试验设计, 是联合治疗设计的一种方法, 一般多在现有临床(如西医)标准治疗基础上加上中药新药或安慰剂, 得到的疗效是多种施加因素的结果, 必然给中药新药的疗效确认和安全性评价带来困难。同时,若标准治疗本身的疗效过高, 出现“天花板” 效应导致无法评价受试药物的疗效, 故在中药新药试验时应慎重选择加载试验设计。
3. 3. 6有效性指标的选择与评价 ①疗效指标的选择, 主要疗效指标不宜太多, 通常只有 1 个;次要疗效指标可以是多个, 它可以为疗效确定提供支持,但不能作为疗效确证性依据。②有效性评价, 一般不建议将定量指标简单地转化为多分类等级指标(如痊愈、 显效、 有效、 无效), 因为这种转化缺乏足够的科学性。目前二分类法是临床上鼓励使用的用于比较临床疗效的评价方法, 建议根据相关适应症及临床试验目的, 对观测指标的有效性设定一个界值, 把计量资料转化成为二分类, 如“有效” “无效”两类, 按照二分类资料进行统计分析比较。
3. 3. 7安全性指标的选择与评价 ①安全性指标设计, 如肝功能相关检测指标需观察丙氨酸氨基转移酶(ALT), 天门冬氨酸氨基转移酶(AST), 总胆红素(TBil), 碱性磷酸酶 (ALP), γ- 谷氨酰转移酶(GGT);肾功能相关检测指标需检测尿常规及尿沉渣镜检, 微量白蛋白尿(即刻尿白蛋白与尿肌酐的比值, UACR), 肌酐( SCr)和/或肾小球滤过率(GFR)(推荐使用简化 MDRD 公式或 CKD- EPI 公式), 尿 N- 乙酰- β- D- 葡萄糖苷酶 ( 尿 NAG 酶)。②安全性评价, 如临床试验中出现了药物性肝损伤的情况, 可采用 RUCAM 评分量表对受试中药与药物性肝损伤之间的因果关系进行评估。
4 小结
版权声明:本文来源于《中国实验方剂杂志》,2019,25,(14)。本网页文章、图片、视频版权归原作者所有,仅供学习参考,如有侵犯版权请联系我们,我们将及时回复。

