中药国家药品标准修订技术要求
摘要
国家药品标准是药品监管的强制性技术准则和法定依据,其制修订工作一直以来都受到社会各界的广泛关注。本文从中药国家药品标准修订基本原则、起草用样品及对照物质要求、检测方法的选择以及分析方法验证等方面介绍了中药国家药品标准修订的基本技术要求,以期增加社会各界对中药国家药品标准修订工作的了解,促进此项工作的进一步完善和提高。
关键词
中药国家药品标准; 技术要求; 分析方法验证
药品标准是药品研发、生产、经营、使用、检验、监督管理等各个环节必须共同遵守的强制性技术准则和法定依据。新修订《药品管理法》第二十八条中规定:“国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。国务院药品监督管理部门会同国务院卫生健康主管部门组织药典委员会,负责国家药品标准的制定和修订。”
中药相关国家药品标准主要有:《中国药典》一部、《卫生部药品标准》中药材第一册、《卫生部药品标准》藏药第一册、《卫生部药品标准》维吾尔药分册、《卫生部药品标准》蒙药分册、《卫生部药品标准》中药成方制剂、《卫生部药品标准》新药转正标准、《国家药品标准》新药转正标准、《国家中成药标准汇编》中成药地方标准上升国家标准部分等。
国家药品标准的制修订工作一直以来都受到社会各界的广泛关注。为指导和规范国家药品标准的研究、起草、修订复核及审定工作,国家药典委员会专门编制出版了《国家药品标准工作手册》[1]。本文以该手册为基础,结合《中国药典》2020 年版四部9101 分析方法验证指导原则[2],对中药国家药品标准修订过程中各环节的相关技术要求进行介绍。
1 中药国家药品标准修订基本原则
自改革开放以来,我国经济迅猛发展,人民生活水平不断提高的同时,健康需求不断增强,对药品生产和监管也提出了新的要求。党和政府高度重视药品工作,习近平总书记对药品安全治理体系提出“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责” 的要求。在中药标准修订过程中也应贯彻“四个最严” 的要求, 坚持保障公共用药安全, 以最严谨的标准作为标准修订的目标。
中药标准研究与基础科学研究不尽相同,要坚持科学、先进、实用的原则。其检测指标应科学合理,所选择的分析方法应先进,但还应同时考虑到检验经济学,兼顾方法的实用性。
2019 年10 月20 日发布的《中共中央 国务院关于促进中医药传承创新发展的意见》中指出,“传承创新发展中医药是新时代中国特色社会主义事业的重要内容,是中华民族伟大复兴的大事。”中药标准修订也应坚持中医药特色,以中医临床为导向,中医药现代研究为基础,坚持继承、发展、创新的原则,不断促进中药健康持续发展。
2 起草用样品及对照物质要求
药品标准研究用样品将直接影响研究结果的可靠性,从而最终影响所拟定标准的科学性和可执行性。因此,在开展标准修订研究时应特别注意研究样品的代表性。一般应收集15 批以上供研究用样品。在提出质量标准草案后,还应通过不同实验室协同检验获得重现性结果。因此,药品标准研究样品量除满足起草研究、留样观察外,还应提供不少于3 倍检验量的样品供复核用。
中药材和饮片的伪品如混入研究样品,可能对研究结果产生严重影响。在研究开始时,应对中药材及饮片样品进行系统鉴定,以保证样品基原准确可靠。对于多来源中药材品种,每个种应收集不少于3 批样品,并标明产地(如有可能标明野生或家种)、收集地、收集时间、收集人等信息。
对于中成药样品,如为独家生产品种,应收集不少于10 批样品;对于多家企业生产品种应尽量收集每家企业的样品;5 家以上企业生产的品种应至少收集5~10 家企业生产的样品。对于具有多种不同规格的中成药,应收齐全部规格的样品。试验用样品必须采用合格原辅料依法定生产工艺生产的样品,防止原辅料以及生产工艺对样品产生影响。
标准物质是药品标准的有机组成。标准物质的赋值及其稳定性等均会对测定结果产生影响,并最终影响标准的科学性和可执行性。药品质量标准制定过程中应使用国家药品标准物质。如新增标准物质,应在申报标准草案的同时,按照相关规定向中国食品药品检定研究院报送用于标定的标准物质及其研究资料,以保证拟定标准所使用的对照物质植物基原、化学结构以及赋值正确合理。
3 检测方法的选择
中药成份复杂,单一指标往往难以全面控制其质量。在中药标准制定过程中应遵循整体控制思想,尽量选择多组份测定、生物测定以及指纹图谱或特征图谱等方法。
随着人民生活水平的提高,中药有害残留问题也越来越受到重视。在中药标准工作中也应关注农药残留、真菌毒素、二氧化硫残留等项目,切实保证中药用药安全。
保护生态环境是全球面临的共同挑战和共同责任。中药检验过程中普遍使用的化学试剂也会给环境保护带来压力。在药品标准研究时应考虑如何减少化学溶剂尤其是有毒有害溶剂的使用,采用一测多评等方法减少对照物质使用,不同检测项目共用供试品溶液,以减少化学废弃物的产生与排放,促进“绿色化”中药检测标准形成[4]。
4 分析方法验证
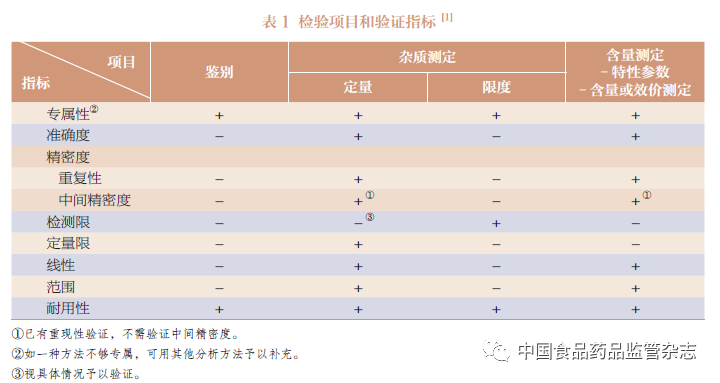
分析方法验证的目的是证明建立的方法适合于相应检测要求。在药品质量标准建立和修订时,需对分析方法进行验证。《中国药典》自2000 年版开始收载分析方法验证指导原则,为药品分析方法建立提供指导。《中国药典》2020 年版四部9101 分析方法验证指导原则中规定的验证指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围和耐用性等,不同的分析项目相应的验证指标见表1[1,5]
5 小结
科学研究是国家药品标准修订的基础,但标准工作在基本原则、样品收集、方法选择和方法学验证等方面均有特殊要求,不完全等同于普通的研究工作。《中国药典》2020 年版已于2020 年12 月30 日正式生效[8],第十二届药典委员会成立工作也已启动,国家药品标准修订工作又将翻开新的一页。希望通过本文可增加社会各界对中药国家药品标准修订工作的了解,以期有更多的中药科研、生产和检验领域单位参与到中药国家药品标准修订工作中,共同促进中药国家标准的进一步完善和提高。

